Zellforscher identifizieren neuen Biosynthese-Mechanismus
 Marburg/Berlin 4.9.2010 (wm/red) Wissenschaftler der Philipps-Universität Marburg haben einen Mechanismus aufgeklärt, der Zellen höherer Lebewesen in die Lage versetzt, Enzyme mit Eisen-Schwefel-Zentren herzustellen.
Marburg/Berlin 4.9.2010 (wm/red) Wissenschaftler der Philipps-Universität Marburg haben einen Mechanismus aufgeklärt, der Zellen höherer Lebewesen in die Lage versetzt, Enzyme mit Eisen-Schwefel-Zentren herzustellen.
Die Wissenschaftler um Professor Roland Lill und Privatdozent Antonio Pierik berichten in der aktuellen Online-Ausgabe der Fachzeitschrift „Nature Chemical Biology“ über ihre Ergebnisse.
„Enzyme mit Eisen-Schwefel-Clustern sind unersetzlich für zahlreiche essenzielle Lebensprozesse“, erläutert Lill, Senior-Autor der Studie. Beispiele hierfür sind insbesondere die Energiegewinnung in den Mitochondrien, die Proteinherstellung an Ribosomen, die Vervielfältigung der Erbsubstanz DNA sowie deren Reparatur nach Schädigungen.
„Eisen-Schwefel-haltige Proteine finden sich daher sowohl bei Bakterien als auch in den Zellen von höheren Lebewesen mit echtem Zellkern“, ergänzt Koautor Pierik, „also etwa bei Pflanzen und Tieren“.
Elektronenstrom führt zu stabilen Eisen-Schwefel-Proteinen
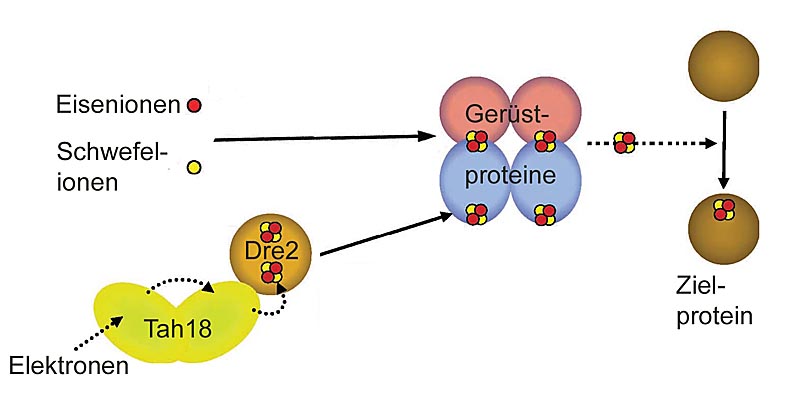
Lill, Pierik und Kollegen identifizierten einen neuen, wesentlichen Bestandteil der zellulären Maschinerie, die in kernhaltigen Organismen die Biosynthese von Eisen-Schwefel-haltigen Proteinen bewerkstelligt. Die Wissenschaftler nahmen sich das Protein Tah18 vor, das sie zellbiologisch, biochemisch und spektroskopisch untersuchten. Sie fanden heraus, dass Tah18 mit einer weiteren Komponente der Maschinerie zusammenwirkt, nämlich mit Dre2, das seinerseits ein Eisen-Schwefel-Protein ist.
Nach Modell der Marburger Zellbiologen um Roland Lill und Antonio Pierik ist Tah18 Teil einer Transportkette, die Elektronen auf Eisen-Schwefel-Cluster des Proteins Dre2 überträgt. Der Elektronenfluss ist erforderlich, um Eisen-Schwefel Cluster stabil in Zielproteine zu integrieren, nachdem sie an Gerüstproteinen synthetisiert worden sind. (Abbildung: AG Lill)
Dabei bildet Tah18 zusammen mit Dre2 eine Elektronen-Transportkette, die für die stabile Integration von Eisen-Schwefel-Clustern in Zielproteine essentiell ist. Die anorganischen Kofaktoren werden zunächst an Gerüstproteinen zusammengesetzt und anschließend über mehrere Zwischenschritte an die Zielproteine weitergereicht.
Wie die Erstautorin Dr. Daili Netz weiter zeigen konnte, ist der neu entdeckte Mechanismus auch für den Menschen von Bedeutung. Schaltet man in Hefezellen Tah18 oder Dre2 aus, so können menschliche Proteine deren Funktion ersetzen – diese hat sich also während der gesamten Evolution erhalten, die von Einzellern zu hoch entwickelten Tieren geführt hat.
Hintergrundinformation
Die Arbeitsgruppe von Roland Lill ist Teil des Sonderforschungsbereiches 593 der Deutschen Forschungsgemeinschaft sowie des Forschungsschwerpunkts Molekulare und systemische Biowissenschaften an der Philipps-Universität. Dem jüngsten Ranking der Zeitschrift „Laborjournal“ zufolge gehört Lill zu den dreißig meistzitierten deutschen Zellbiologen. Schon im Jahr 2003 hat er den Leibnizpreis erhalten, den am höchsten dotierten deutschen Wissenschaftspreis.
Originalpublikation Daili J. A. Netz & al.: Tah18 transfers electrons to Dre2 in cytosolic iron-sulfur protein biogenesis, Nature Chem. Biol. 29. August 2010, DOI: 10.1038/NCHEMBIO.432
Weitere Informationen
- Ansprechpartner Professor Roland Lill
- Institut für Klinische Zytobiologie und Zytopathologie
- Telefon 06421 28-66449
- E-Mail lill@staff.uni-marburg.de