Wie das Eisen zum Eiweiß kommt
Verteilung von Spurenelementen in der Zelle in Marburg erforscht
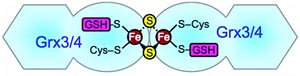 Marburg 11.10.2010 (wm/red) Marburger Wissenschaftler im internationalen Team haben herausgefunden, wie das Spurenelement Eisen an seine Zielorte in der Zelle gelangt. Die Enzyme Glutaredoxin 3 und 4 (Grx3/4), die für die innerzelluläre Eisenverteilung verantwortlich sind, kommen bei allen Organismen vor, die aus Zellen mit echtem Kern bestehen – also bei einzelligen Pilzen ebenso wie bei Pflanzen, Tieren und beim Menschen. Das berichtet das Team um Professor Roland Lill von der Philipps-Universität Marburg in der aktuellen Ausgabe der Fachzeitschrift „Cell Metabolism“.
Marburg 11.10.2010 (wm/red) Marburger Wissenschaftler im internationalen Team haben herausgefunden, wie das Spurenelement Eisen an seine Zielorte in der Zelle gelangt. Die Enzyme Glutaredoxin 3 und 4 (Grx3/4), die für die innerzelluläre Eisenverteilung verantwortlich sind, kommen bei allen Organismen vor, die aus Zellen mit echtem Kern bestehen – also bei einzelligen Pilzen ebenso wie bei Pflanzen, Tieren und beim Menschen. Das berichtet das Team um Professor Roland Lill von der Philipps-Universität Marburg in der aktuellen Ausgabe der Fachzeitschrift „Cell Metabolism“.
Funktion von Eisen als lebenswichtige Verbindung
Ohne Eisen gibt es kein Leben. Das Metall ist ein unverzichtbarer Bestandteil lebenswichtiger Verbindungen. Beispielsweise sorgt es im Blutfarbstoff Hämoglobin dafür, dass Sauerstoff gebunden wird. Bislang wusste man nicht, wie Eisen innerhalb der Zelle dorthin transportiert wird, wo es benötigt wird. Die Wissenschaftler um Lill und Dr. Ulrich Mühlenhoff nutzen Hefezellen als Modell, um die Funktion der Glutaredoxine 3 und 4 zu untersuchen. Glutaredoxine bilden eine große Proteinfamilie und können vielfältige Funktionen erfüllen, etwa als innerzelluläre Eisensensoren oder bei Reaktionen, die Elektronen von einem Molekül auf ein anderes übertragen.
Ergebnisse bedeutend für Erkenntnisse zu Stoffwechselkrankheiten
Die Ergebnisse von Lill und seinen Kollegen weisen in eine unbekannte Richtung. „Unsere Befunde zeigen, dass Glutaredoxin 3 und 4 eine entscheidende Rolle für den Transport von Eisen zu dessen eigentlichem Zielort innerhalb der Zelle spielen“, schreiben die Autoren. So sind die Hefezellen nicht in der Lage, eisenhaltige Proteine herzustellen, wenn Grx3/4 ausgeschaltet wird. Der Grund liegt darin, dass das Metall nicht in die Eiweißverbindungen eingebaut werden kann, obwohl es in hoher Konzentration in der Zelle verfügbar ist.
Die Transportfunktion von Grx3/4 beruht ihrerseits auf einem Eisen-Schwefel-Zentrum, wie die Zellforscher belegen können. „Die zentrale Bedeutung von Grx3/4 für den innerzellulären Eisentransport könnte erklären, warum diese Proteinfamilie bei allen Organismen mit echtem Zellkern vorkommen“, vermuten die Wissenschaftler. Die Studien sind von besonderer Bedeutung, da Eisenmangel zu den häufigsten Stoffwechselerkrankungen beim Menschen gehört.
Sonderforschungsbereich für Zellbiologie
Die Arbeitsgruppe von Roland Lill ist Teil des Forschungsschwerpunkts Molekulare und systemische Biowissenschaften an der Philipps-Universität Marburg sowie des Sonderforschungsbereiches 593 der Deutschen Forschungsgemeinschaft, der „Mechanismen der zellulären Kompartimentierung und deren krankheitsrelevante Veränderungen“ studiert. Dem jüngsten Ranking der Zeitschrift „Laborjournal“ nach zählt der Hochschullehrer zu den am meisten zitierten deutschen Zellbiologen. Bereits 2003 hat er den Leibnizpreis erhalten, den höchst dotierten deutschen Wissenschaftspreis.
Lill gehört dem Steuerungskomitee des Marburger „LOEWE“-Zentrums für Synthetische Mikrobiologie an. Die neue Forschungsarbeit wurden von der „Von Behring-Röntgen-Stiftung“ und der Max-Planck-Gesellschaft finanziell gefördert.
Originalveröffentlichung
Ulrich Mühlenhoff & al.: Cytosolic monothiol glutaredoxins function in intracellular iron sensing and trafficking via their bound iron-sulfur cluster, Cell Metabol. 12 (4) 2010, 373-85.











