Vielseitigkeit verspricht Erfolge in der Tumortherapie – Publikation von Forschungsergebnissen aus Marburg

Prof. Thorsten Stiewe und Dr. Oleg Timofeev und Kollegen berichten in ‚Cell Reports‘ über die Funktion des krebsunterdrückenden Gens p53. Foto nh
Marburg 10.5.2013 (pm/red) Dass gegen Krebs nicht alleine und nicht nur ein Kraut gewachsen ist, könnte als Zusammenfassung neuer Forschungsergebnisse aus Marburg gelten: Mediziner um Professor Thorsten Stiewe und Dr. Oleg Timofeev von der Philipps-Universität haben jetzt dazu Grundlegendes zum Gen p53 publiziert. Die beteiligten Forscher aus Marburg und Würzburg untersuchten, wie ein wichtiges Protein wirkt, das normalerweise Krebs verhindert. Das Molekül nutzt demnach viele verschiedene Mechanismen, um vor den unterschiedlichen Krebsarten zu schützen, schreiben die Wissenschaftler in der aktuellen Ausgabe der frei zugänglichen Zeitschrift ‚Cell Reports‘ vom 9. Mai 2013.
Beim Versuch, Genveränderungen zu erkennen, die Krebs verursachen, sind Wissenschaftler immer wieder auf das Gen p53 gestoßen, das in vielen Krebszellen auf die eine oder andere Weise abgewandelt ist. „Mehr als 50 Prozent aller Krebspatienten tragen Mutationen im Gen p53 oder aber in Genen, die p53 beeinflussen“, erläutert Seniorautor Thorsten Stiewe. Anscheinend können Tumore nur entstehen, wenn p53 nicht ordnungsgemäß funktioniert.
Gegenwirkung auf mehreren Wegen
Das Molekül wirkt Krebserkrankungen auf mehreren Wegen entgegen, wie Stiewe darlegt: „Zum einen fördert p53 die zelleigene Reparatur der Erbsubstanz DNA, wodurch Schädigungen beseitigt werden. Man spricht daher auch vom ‚Wächter des Genoms‘.“ Das Protein könne aber auch die Zellteilung stoppen, damit DNA-Schäden, wenn sie denn einmal aufgetreten sind, nicht an Tochterzellen weitergegeben werden. „Und falls das Erbgut extrem geschädigt ist, aktiviert p53 sogar ein zelleigenes Selbstmordprogramm, durch das eine bösartig entartete Zelle für immer aus dem Organismus verbannt wird.“
Stiewe und seine Kollegen konnten bereits vor geraumer Zeit zeigen, dass sich die zellschützenden und die zelltötenden Wirkungen des Moleküls experimentell trennen lassen. Um Zellen abzutöten, müssen nämlich mehrere p53-Moleküle miteinander in Kontakt treten. „Sie müssen sich quasi die Hände reichen, um Hand in Hand auf den Zelltod hinzuarbeiten“, veranschaulicht Stiewe die Interaktion. Für die zellschützenden Wirkungen ist diese molekulare Zusammenarbeit dagegen nicht nötig.
Um die Funktionsweise von p53 genauer aufzuklären, erzeugten die Forscher einen Mausstamm, dessen p53-Gen künstlich verändert ist:
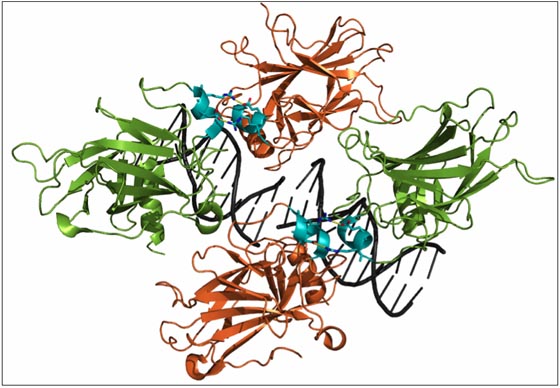
Vier p53-Moleküle (in orange und grün) treten miteinander in Wechselwirkung; die Kontaktstellen sind türkis hervorgehoben. Vier p53-Moleküle (in orange und grün) treten miteinander in Wechselwirkung; die Kontaktstellen sind türkis hervorgehoben. Vier p53-Moleküle (in orange und grün) treten miteinander in Wechselwirkung; die Kontaktstellen sind türkis hervorgehoben. Quelle: RCSB Protein Data Bank.
Die Kontaktstellen, an denen die Moleküle normalerweise interagieren, sind entfernt. Das Ergebnis: p53 ist in den betroffenen Tieren nicht in der Lage, Zellen abzutöten, behält aber seine zellschützenden Funktionen. Die Mäuse sterben bereits im Alter von etwa einem Jahr an Krebs, während sie normalerweise zwei bis drei Jahre alt werden.
Fehlt p53 gar vollständig, so verenden die betroffenen Mäuse noch früher, aber an ganz anderen Arten von Krebs. „Die zellschützenden und zelltötenden Funktionen von p53 bewahren dessen Träger vor unterschiedlichen Krebsformen“, fasst Stiewe zusammen. „Ein vollkommener lebenslanger Schutz ist nur dann garantiert, wenn alle Funktionen intakt sind.“
Offenbar gebe es keine pauschale Möglichkeit, Krebs zu bekämpfen, schlussfolgert Studienleiter Stiewe aus den Ergebnissen der Experimente. „Selbst die Natur nutzt unterschiedliche Wege, um diese Erkrankung zu verhindern.“ Den gegenwärtigen Trend zu einer „personalisierten Medizin“ – einer an den jeweiligen Patienten und deren individuellem Krankheitsbild angepassten Therapie – hält der Krebsforscher daher für vielversprechend. „Die Natur macht es nicht anders.“
Stiewe arbeitet am Institut für Molekularbiologie und Tumorforschung und lehrt seit dem Jahr 2007 Molekulare Onkologie an die Philipps-Universität. Er gehört der Klinischen Forschergruppe 210 zur „Genetik der Wirkstoffresistenz bei Krebs“ und weiteren Verbünden der Deutschen Forschungsgemeinschaft an. 2011 erhielt Stiewe einen ‚Starting Grant‘ des Europäischen Forschungsrates (ERC).
Die aktuelle Studie wurde von der Deutschen Forschungsgemeinschaft, dem European Research Council, der Deutschen Krebshilfe, der von-Behring-Röntgen-Stiftung, dem Land Hessen (Universities of Giessen and Marburg Lung Center) und der Deutschen José Carreras Leukämie Stiftung gefördert.
Originalveröffentlichung: Oleg Timofeev & al.: p53 DNA binding cooperativity is essential for apoptosis and tumor suppression in vivo. —>Cell Reports 3/2013










