Angeborenes Immunsystem von internationalem Wissenschaftlerteam erforscht
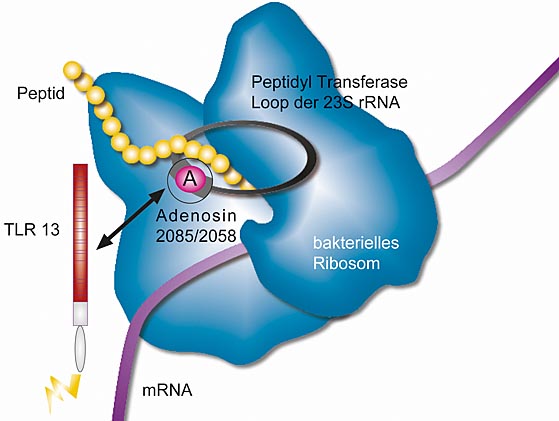
Ein spezifisches Segment der bakteriellen 23S ribososmalen (r) RNA aktiviert den Toll-like Rezeptor 13. Es ist bereits bekannt, dass dieses 23S rRNA-Segment Antibiotika wie Erythromycin bindet. Sein zentrales Adenosin (A) 2085 in S. aureus und A2058 in E. coli 23S rRNA ist in Erythromycin-resistenten Bakterien mutiert oder methyliert. Abbildung Daniela Willemsen
Marburg 21.7.2012 wm/red) Bakterien, Viren, Pilze und Parasiten umgeben uns. Dass wir trotzdem nicht krank werden, liegt an bestimmten zellulären Sensoren, wie den ‚Toll-like Rezeptoren‘ (TLR). Sie erkennen molekulare Muster von Erregern und leiten meist völlig unbemerkt deren Vernichtung ein. Diese immunaktivierenden Fähigkeiten wurden erst 1998 entdeckt. Es gab dafür den Nobelpreis. Jetzt untersuchte ein internationales Forscherteam unter Marburger Beteiligung die komplexe Erkennung von Bakterien. Die Ergebnisse sind im Wissenschaftsmagazin ‚Science‘ nachzulesen.
Unser angeborenes Immunsystem ist klug. Es erkennt bestimmte Strukturen, die charakteristisch für viele Mikroorganismen sind, und schlägt Alarm. Toll-like Rezeptoren lösen dann eine Entzündungsreaktion aus. Das kann aber auch gefährlich werden. Weil TLR so empfindlich sind, kommt es bei schweren Infektionen zum Überschießen der Immunantwort. Die Folge sind Blutvergiftung und oftmals ein septischer Schock.
Deshalb nahmen die Experten um Professor Carsten Kirschning von der Universität Duisburg-Essen und Professor Stefan Bauer von der Philipps-Universität die Wirtserkennung von Staphylokokken- und E.coli-Bakterien, die häufig Blutvergiftungen auslösen, unter die Lupe. Sie konnten nachweisen, dass TLR13 ein spezifisches Segment der bakteriellen ribosomalen Ribonukleinsäure erkennt. Daran binden sich auch spezifische Antibiotika wie zum Beispiel Erythromycin, falls das Segment nicht wie bei resistenten Erregern verändert ist. Die konkrete Ribonukleinsäure wird als 23S rRNA bezeichnet. „Tierische und menschliche Ribosomen binden Erythromycin hingegen nicht an ihre 28S rRNA, weil ihre Struktur diesbezüglich der von 23S rRNA resistenter Bakterien ähnelt“, erklärt Kirschning.
Bedeutsam sind die neuen Erkenntnisse für die Behandlung bakterieller Infektionen und das Verständnis von Antibiotika-Resistenzen. Außerdem könnten sie bei der Therapie von immunologischen Überreaktionen helfen und neue Impfstrategien eröffnen.
Die Studie und die daran Beteiligten
Die Studie stammt von einem internationalen Forscherteam um Professor Carsten Kirschning vom Institut für Medizinische Mikrobiologie des Universitätsklinikums Essen der UDE, Privatdozent Dr. Hubertus Hochrein von der Firma Bavarian Nordic GmbH in Martinsried, Professor Stefan Bauer vom Institut für Immunologie der Phillips-Universität und Professor Hermann Wagner vom Institut für Medizinische Mikrobiologie, Immunologie und Hygiene der Technischen Universität München. Dazu gehören weitere Wissenschaftler aus München, der Schweiz und Japan. Die Marburger Arbeitsgruppe behandelte unter anderem 23S ribosomale RNA aus Bakterien mit speziellen Enzymen, die einen bestimmten Baustein der RNA chemisch modifizieren, so dass diese nicht von TLR13 erkannt wird.
Originalveröffentlichung
Marina Oldenburg, Anne Krüger, Ruth Ferstl & al.: TLR13 recognizes bacterial 23S rRNA devoid of erythromycin resistance-forming modification, Science 19. Juli 2012










