Evolutionsbiologie: Urzelle LUCA entstand durch Wasserstoffenergie
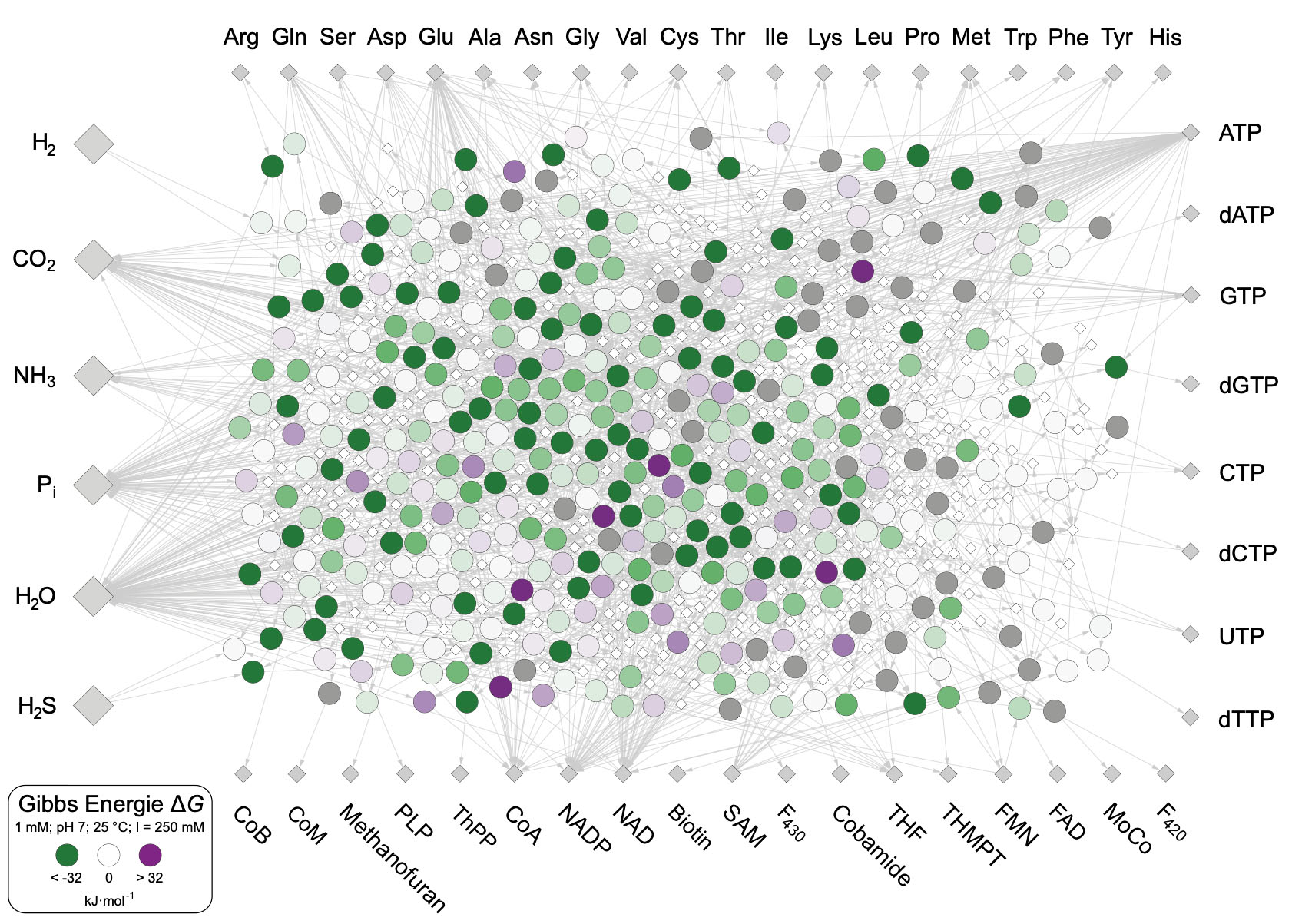
Stoffwechsel von LUCA: Das Forschungsteam untersuchte 402 biochemische Reaktionen, die zur Biosynthese der Grundbausteine des Lebens benötigt werden. Jeder Kreis repräsentiert eine dieser Reaktionen und dessen Farbe steht für die Energie, die bei der Reaktion frei wird: Grüne Reaktionen setzen Energie frei, violette dagegen benötigen zusätzliche Energie von außen. Abbildung: HHU / Jessica Wimmer
11.12.2021 (pm) Woher kam der Urstoffwechsel, aus dem das Leben entstand? Forschende der Heinrich-Heine-Universität Düsseldorf (HHU) haben jetzt den Stoffwechsel der allerersten Lebensform, der Urzelle LUCA, rekonstruiert. Dabei kam ans Licht, dass fast alle chemischen Reaktionen, die am Aufbau der molekularen Bausteine der Urzelle beteiligt waren, Energie freisetzen. Somit diente der Urstoffwechsel selbst als interne Energiequelle, sofern der älteste und zugleich modernste Energieträger vorhanden war: Wasserstoffgas, H2.
Das Team um Prof. Dr. William Martin, Leiter des HHU-Instituts für Molekulare Evolution, erforscht, wie und wo das frühe Leben auf der Erde entstand. Dazu führen sie einerseits chemische Versuche im Labor mit simulierten Hydrothermalquellen durch, andererseits sammeln sie die Spuren vom Ursprung des Lebens im Erbgut heutiger Mikroben und deuten diese im Kontext der Bedingungen auf der frühen Erde. Schon 2016 fanden sie heraus, dass der letzte gemeinsame Vorfahre allen Lebens LUCA (für last universal common ancestor) hydrothermale Tiefseequellen besiedelte.
Stoffwechselreaktionen vom Ursprung des Lebens
In ihrer neuen Publikation untersuchen sie, wo LUCAs Stoffwechsel entstand, indem sie die Fragen klärten, wie LUCA seine Grundbausteine aufbaute und woher die dafür erforderliche Energie kam. Hierzu konnte Martins Team 402 Stoffwechselreaktionen identifizieren, die sich vom Ursprung des Lebens vor rund 4 Milliarden Jahren bis heute kaum verändert haben. Diese waren demnach schon in LUCA vorhanden und werfen Licht auf die Frage, wie LUCA mit Energie umging und woher er seine Energie bezog.
Jessica Wimmer, Doktorandin am Düsseldorfer Institut und Erstautorin der neuen Studie, interessierte sich vor allem für die Energiebilanz von LUCAs Stoffwechselreaktionen, denn: Alles Leben braucht Energie. Dazu untersuchte sie mit ihrem Forschungsteam bei ursprünglichen Mikroben die biochemischen Reaktionen, mit denen diese ihre Grundbausteine für Zellstruktur und -funktion aufbauen. Daraus ergab sich ein umfassendes Reaktionsnetzwerk, das bereits bei LUCA vorgelegen haben muss.
Genese in Hydrothermalquellen der frühen Erde
Es sind insgesamt 402 einzelne chemische Reaktionen, bei denen die 20 Aminosäuren entstehen, aus denen wiederum alle in Lebewesen vorkommenden Proteine aufgebaut sind; ferner bilden diese Reaktionen die Basen der Nukleinsäuren, die sich in der DNA bzw. RNA wiederfinden und 18 wichtige Vitamine, die für den Stoffwechsel unerlässlich sind. All diese Komponenten entstehen bei primitiven Mikroben – aber auch in Wimmers Computerberechnungen – aus den grundlegenden Molekülen Wasserstoff (H2), Kohlendioxid (CO2) und Ammoniak (NH3), die es an Hydrothermalquellen der frühen Erde in ausreichender Menge gab.
Wimmer zu ihrer Forschungsfrage: „Wir wollten wissen, woher der ursprüngliche Stoffwechsel seine Energie bezog. Denn vor vier Milliarden Jahren gab es noch keine Enzyme, die in heutigen Zellen die Reaktionen katalysieren. Die Reaktionen mussten vielmehr in der damaligen Umwelt von sich aus stattfinden können. Es gab schon viele Vermutungen, woher die treibende Energie hätte stammen können. Im Stoffwechsel selber hatte aber noch niemand gesucht.“ Dazu untersuchte das Team die Energiebilanz jeder Reaktion anhand ihrer freien Energie, auch Gibbs-Energie genannt.
Stoffwechsel ohne externe Energiequellen
Ihr Ergebnis: LUCA war für seinen Stoffwechsel auf keine externen Energiequellen wie UV-Licht, Meteoriteneinschläge, Vulkanausbrüche oder Radioaktivität angewiesen. Vielmehr liefern – in einer Umgebung, die sich bei Hydrothermalquellen finden lässt – die grundlegenden Reaktionen selbst die Energie für den Stoffwechsel. Oder anders ausgedrückt: Der Großteil von LUCAs chemischen Reaktionen setzt sogar Energie frei. Die Energie für das Leben ist im Leben selbst enthalten. „Das ist deshalb aufregend,“ sagt Prof. Martin, Letztautor der Studie, „weil der sonst so komplizierte Stoffwechsel auf einmal eine natürliche Tendenz offenbart, sich unter den richtigen Bedingungen von alleine zu entfalten.“
Um zu diesem überraschenden Schluss zu gelangen, untersuchte das Team die Energetik der 402 Reaktionen mit Computermodellen unter vielen unterschiedlichen Umweltbedingungen, um energetisch günstige von energetisch ungünstigen Konstellationen zu unterscheiden. Denn ob eine Reaktion Energie freisetzt, hängt zum Teil von den herrschenden Umweltbedingungen ab. Sie spielten pH-Werte von 1 (sauer) bis 14 (alkalisch), Temperaturen von 25 bis 100 °C sowie unterschiedliche Konzentrationsverhältnisse der Ausgangsstoffe (Reaktanden) zu den Reaktionsprodukten durch, Auch die energetische Rolle des Wasserstoffs wurde bewertet. Wimmer: „Ohne Wasserstoff geht gar nichts, weil dieser benötigt wird, um das CO2 überhaupt in den Stoffwechsel einzuschleusen.“
Ursprung des Lebens rein chemischer Natur
Die energetisch optimalen Bedingungen lagen im Bereich eines alkalischen pH-Wertes um etwa 9 und einer Temperatur von 80 °C. Wasserstoff diente zur CO2-Fixierung. Prof. Martin ordnet diese Ergebnisse ein: „Dieses Milieu entspricht genau der Umgebung, die man im Hydrothermalfeld ‚Lost City‘ im Atlantis-Massiv, einem unterseeischen Gebirge im Mittelatlantik, vorfindet. In dieser Umgebung könnten rund 97 Prozent der 402 Reaktionen spontan ablaufen, also ohne zusätzliche Energiezufuhr. In dieser Umgebung ist Wasserstoff in jeder Hinsicht chemisches Sonnenlicht. Die moderne Energieforschung nutzt genau die gleichen Eigenschaften des Wasserstoffs wie das Leben. Nur hat das Leben schon vier Milliarden Jahre Erfahrung damit, wir fangen gerade erst an.“
Jessica Wimmer ergänzt: „Wir haben gezeigt, dass die Energie am Ursprung des Lebens rein chemischer Natur ist. Wir brauchen kein Sonnenlicht, keine Meteoriten, kein UV Licht: nur H2 und CO2, plus etwas Ammoniak und Salz. Und aus unserem biosynthetischen Netzwerk können wir auf die Eigenschaften von LUCA zurückschließen, über Milliarden von Jahren hinweg.“
Originalpublikation
Jessica L. E. Wimmer, Joana C. Xavier, Andrey d. N. Vieira, Delfina P. Pereira, Jacqueline Leidner, Filipa L. Sousa, Karl Kleinermanns, Martina Preiner, William F. Martin, Energy at origins: Favorable thermodynamics of biosynthetic reactions in the last universal common ancestor (LUCA), Frontiers in Microbiology (2021).
DOI: 10.3389/fmicb.2021.793664










